Դասի թեմա՝ Իոնային կապ
Քիմիական կապը ատոմների միջև փոխազդեցություն է, ինչի արդյունքում առաջանում են մոլեկուլներ (բյուրեղներ):
Քիմիական կապն ունի էլեկտրական բնույթ: Այն իրականանում է քիմիական կապին մասնակցող ատոմների միջուկների և էլեկտրոնների էլեկտրաստատիկական փոխազդեցության (և՛ ձգողության, և՛ վանողության) շնորհիվ:

Քիմիական կապի էներգիան տատանվում է լայն տիրույթում (40-ից մինչև 1000 կՋ/մոլ), ինչը պայմանավորված է ատոմների միջև տարբեր տեսակի փոխազդեցություններով:
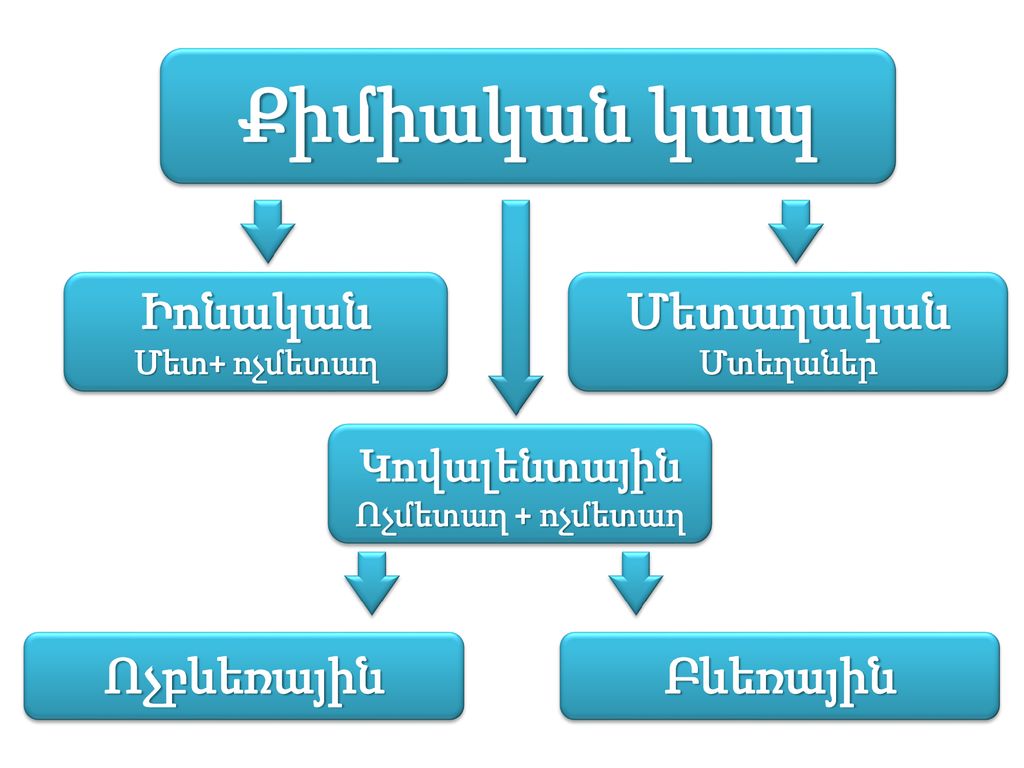
Ներկայումս տարբերում են քիմիական կապի մի քանի տեսակներ՝ իոնային, կովալենտային, մետաղական և ջրածնային:
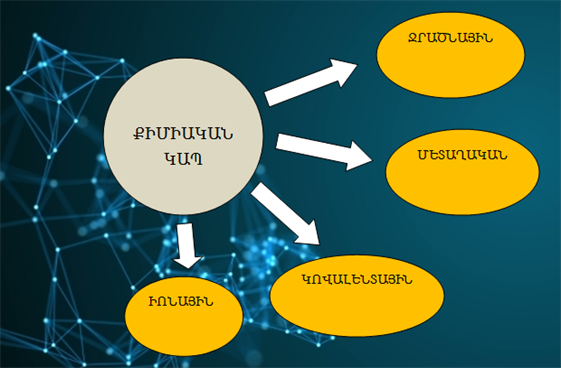
Իոնային կապ
Իոնային քիմիական կապի առաջացման հիմքում ընկած է գերմանացի ֆիզիկոս Վ.Կոսելի այն ենթադրությունը, որ միացություններ առաջացնելիս ցանկացած տարրի ատոմ, որոշակի թվով էլեկտրոններ կորցնելով կամ միացնելով, ձեռք է բերում մոտակա իներտ գազի էլեկտրոնային կառուցվածքը:

Վ.Կոսել
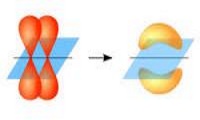
Իոնային կապ կարող է առաջանալ էլեկտրաբացասականության արժեքների մեծ տարբերությամբ տարրերի՝ մետաղների և ոչ մետաղների ատոմների միջև: Փոքր էլեկտրաբացասականությամբ տարրի ատոմից վալենտային էլեկտրոն(ներ)ը փոխանցվում է(են) ավելի մեծ էլեկտրաբացասականությամբ տարրի ատոմին:
Օրինակ՝ նատրիումի և քլորի ատոմների միջև առաջանում է իոնային կապ, նատրիումի ատոմից վալենտային էլեկտրոնը փոխանցվում է քլորի ատոմին, առաջանում են իներտ գազի էլեկտրոնային կառուցվածքով լիցքակիր մասնիկներ՝ իոններ. Na+ և Cl−, որոնք էլեկտրաստատիկ ուժերով ձգում են միմյանց:
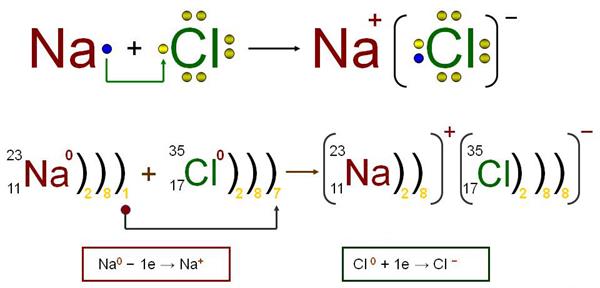
Իոնային կապն իրագործվում է տարանուն լիցքավորված իոնների էլեկտրաստատիկ ձգողությամբ:
Իոնային կապը չունի ուղղորդվածություն՝ որոշակի ուղղությամբ հակառակ լիցք ունեցող իոնին ձգելու հատկություն, քանի որ իոնի լիցքը իոնի մակերևույթի վրա բաշխված է հավասարաչափ և էլեկտրական դաշտի ազդեցությունը տարածվում է բոլոր ուղղություններով հավասարաչափ:
Իոնային կապով միացած իոնները չեն կորցնում հակառակ լիցքով այլ իոններ ձգելու հատկությունը, այսինքն՝ իոնային կապը չունի հագեցվածություն:
Իոնային կապի հագեցվածություն չունենալու հատկության շնորհիվ է, որ իոններն ասոցացվելով ստեղծում են իոնային բյուրեղներ՝ իոնային բյուրեղավանդակով միացություններ:
Օրինակ՝
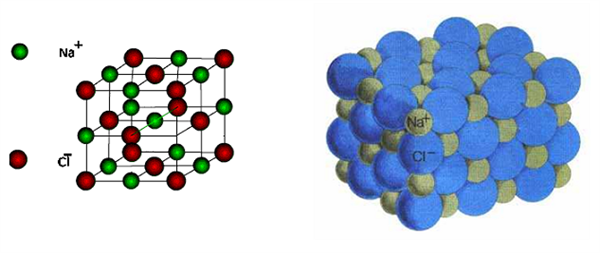
Իոնային կապ կարող է լինել ոչ միայն երկտարր միացություններում, այլ նաև բազմատարր միացություններում, բարդ՝ բազմատարր իոնների միջև:
Օրինակ՝ անջուր կալցիումի սուլֆատի բյուրեղավանդակի հանգույցներում գտնվում են Ca2+ պարզ՝ միատոմանի և SO2−4 բարդ՝ բազմատոմանի իոններ:
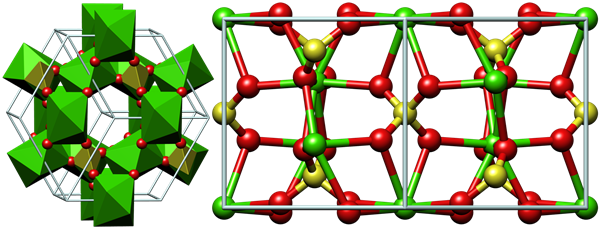
Իոնային բյուրեղավանդակ ունեցող նյութերը, շնորհիվ իոնային կապի մեծ էներգիայի, բնութագրվում են հալման բարձր ջերմաստիճանով, որոշակի կարծրությամբ:
Իոնային կապի էներգիան (բյուրեղավանդակի էներգիան) մեծապես պայմանավորված է իոնի լիցքի խտությամբ՝ իոնի միավոր մակերեսին բաժին ընկնող լիցքի մեծությամբ:
Օրինակ՝ LiCl-ի բյուրեղավանդակի էներգիան ավելի մեծ է, քան NaCl-ինը, ինչը բացատրվում է նատրիումի կատիոնի համեմատությամբ լիթիումի կատիոնի լիցքի ավելի մեծ խտությամբ:


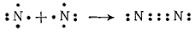



 :
: