Սովորել՝ Ջրածին։ Հասկացողություն թթուների և աղերի մասին։
Էջ՝ 129-133

Ջրածինը (Hydrogenium` լատիներեն ջուր ծնող) պարբերական համակարգի առաջին պարբերության՝ առաջին խմբի, մեկ կարգաթվով տարրն է:

ջրածին տարրի նշանը
Ջրածնի ատոմն ունի ամենապարզ կառուցվածքը` մեկ դրական լիցքով միջուկի շուրջը սփռված է մեկ էլեկտրոն:

ջրածնի ատոմի կառուցվածքը
Միացություններ առաջացնելիս ջրածինը հիմնականում ցուցաբերում է մետաղական հատկություն, այսինքն՝ տալիս է մեկ էլեկտրոն և ձեռք է բերում +1 լիցք:
H0−1e→H+
Իսկ որոշ պայմաններում ոչ մետաղական հատկություն` ընդունում է էլեկտրոն (օրինակ՝ մետաղների հետ առաջացած միացություններում) և ձեռք բերում −1օքսիդացման աստիճան:
H0+1e−→−H−
Միացությունների ձևով ջրածինը չափազանց տարածված տարր է: Նա կազմում է ջրի զանգվածի 11 %-ը, մտնում է բոլոր բուսական` մրգերի, բանջարեղենների, թթուների, և կենդանական նյութերի` ճարպերի, սպիտակուցների, ածխաջրերի, նավթի, և շատ այլ հանքային նյութերի բաղադրության մեջ:
Նա կազմում է արեգակի և աստղերից շատերի զանգվածի կեսից ավելին: Արեգակնային համակարգի ամենամեծ մոլորակը` Յուպիտերը, համարյա լրիվ կազմված է ջրածին քիմիական տարրից: Ցածր ջերմաստիճանի և շատ բարձր ճնշման պատճառով ջրածինն այդ մոլորակի վրա գտնվում է պինդ վիճակում:
Ջրածին տարր պարունակող ցանկացած միացություն պարունակում է ջրածնի երկու իզոտոպ` պրոտիում ( 99,98) և դեյտերիում (0,02): Աննշան քանակությամբ հանդիպում է նաև երրորդ իզոտոպը` տրիտիումը:

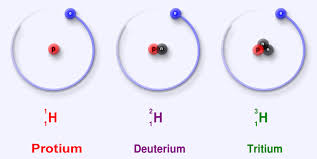
ջրածնի իզոտոպները
Ջրածին տարրն առաջացնում է ջրածին պարզ նյութը՝
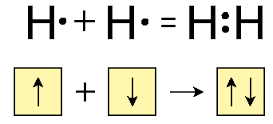
Ջրածնի մոլեկուլի բանաձևն է՝ H2, հարաբերական մոլեկուլային զանգվածը՝ 2,016 (կլորացված 2), մոլային զանգվածը՝ 2 գ/մոլ՝
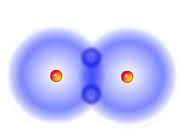
ջրածնի մոլեկուլի մոդելը
Ջրածինը բնության մեջ ազատ վիճակում հանդիպում է չնչին քանակով՝ գլխավորապես մթնոլորտի վերին շերտերում: Երբեմն, այն երկրի ընդերքից դուրս է գալիս այլ գազերի հետ հրաբխային ժայթքումների, ինչպես նաև նավթի արդյունահանման ժամանակ:
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
Ո՞ր դեպքում է խոսքը վերաբերում ջրածնին՝ որպես քիմիական տարրի.
ա) ջրածին պարունակում է մարդու օրգանիզմը,
բ) ջրածնի լուծելիությունը ջրում վատ է,
գ) ջրածնի զանգվածային բաժինը ջրում ≈11% է:
Թվարկե՛ք հինգ նյութ, որոնց կազմում ջրածին տարր է առկա:
Մրգերի, բանջարեղենների, թթուների, և կենդանական նյութերի` ճարպերի, սպիտակուցների, ածխաջրերի, նավթի, և շատ այլ հանքային նյութերի բաղադրության մեջ:
Ինչո՞ւ մոլեկուլային ջրածինը չի հանդիպում Երկրի մթնոլորտի ցածր շերտերում:

ջրածնի մոլեկուլի մոդելը
Ջրածինը բնության մեջ ազատ վիճակում հանդիպում է չնչին քանակով՝ գլխավորապես մթնոլորտի վերին շերտերում: Երբեմն, այն երկրի ընդերքից դուրս է գալիս այլ գազերի հետ հրաբխային ժայթքումների, ինչպես նաև նավթի արդյունահանման ժամանակ:
Որքա՞ն է 8 գ զանգվածով ջրածնի
ա) նյութաքանակը (մոլ),-8/2=4
բ.ծավալը։-Ar (H)=8*1
Ո՞ր դեպքում է ջրածնի զանգվածն ավելի մեծ՝ 1 մոլ ջրո՞ւմ, թե՞ 0,5 մոլ մեթանում:
Ջրի զանգվածը Երկիր մոլորակի վրա ≈1,45-10 կգ է: Ի՞նչ զանգվածով (կգ) ջրածին է պարունակում ջուրը:
Հաշվե՛ք ատոմների թիվը 20 գ զանգվածով մոլեկուլային ջրածնում:
Որքա՞ն է ջրածնի զանգվածային բաժինը (%) էթիլսպիրտում՝ C2H5OH:
Ի՞նչ զանգվածով (գ) ցինկ կպահանջվի աղաթթվից 1,12 լ ջրածին դուրս մղելու համար:







