Category: Քիմիա 7
Աղեր:Դասակարգումը:Ստացման եղանակները:Աղերի քիմիական հատկությունները:
Չեզոք աղերը կազմված են մետաղի ատոմներից ու մետաղի ատոմով տեղակալվելու ընդունակ ջրածնի ատոմներ չպարունակող թթվային մնացորդից։
Տարբեր մետաղների չեզոք աղերի օրինակներ՝
| Աղի անվանումը | Աղի բանաձը |
| Նատրիումի նիտրատ | NaNO3 |
| Կալցիումի կարբոնատ | CaCO3 |
| Նիկելի (II) սուլֆատ | NiSO4 |
| Կոբալտի (II) սուլֆատ | CoSO4 |
Թթու աղերը կազմված են մետաղի ատոմներից ու մետաղի ատոմով դեռևս տեղակալվելու ընդունակ ջրածնի ատոմներ պարունակող թթվային մնացորդից։Թթու աղերը բազմահիմն թթուների ոչ լրիվ չեզոքացման արգասիքներն են։
Օրինակ՝
H2SO3+NaOH=NaHSO3+H2O
Թթու աղերն անվանակարգելիս թթվային մնացորդի անվանմանն ավելացվում է «հիդրո» նախածանցը:Որոշ թթու աղերի օրինակներ.
| Աղի անվանումը | Աղի բանաձևը |
| Նատրիումի հիդրոսուլֆատ | NaHSO4 |
| Կալիումի հիդրոֆոսֆատ | K2HPO4 |
| Ամոնիումի երկհիդրոֆոսֆատ | (NH4)H2P O4 |
| Կալցիումի հիդրոկարբոնատ | Ca(HCO3)2 |
Աղերի ստացման եղանակները հիմնված են անօրգանական միացությունների քիմիական հատկությունների վրա:
Աղերի ստացման հիմնական եղանակներն են.
1. հիմքի և թթվի փոխազդեցությունը՝
Ba(OH)2 + 2HCl = BaCl 2+ H2O
2. ալկալու և թթվային օքսիդի փոխազդեցությունը՝
2NaOH + CO2 = Na2SO 3+ H2O
3.ալկալու և լուծելի աղի փոխազդեցությունը (եթե ջրում չլուծվող հիմք է առաջանում)՝
2KOH + CuCl2 = Cu(OH)2↓ + 2KCl
4. հիմնային օքսիդի ու թթվային օքսիդի փոխազդեցությունը՝
MgO + CO2 = MgCO3
5. թթվի ու հիմնային օքսիդի փոխազդեցությունը՝
CuO + 2HCl = CuCl 2+ H2O
6. թթվի ու աղի փոխազդեցությունը, եթե անլուծելի թթու, անլուծելի աղ կամ պակաս ցնդող թթու է առաջանում՝
AgNO3 + HCl = AgCl↓ + HNO3
7.թթվի ու մետաղի փոխազդեցությունը՝
Zn + 2HCl = ZnCl2 + H2↑
8. երկու աղի լուծույթների փոխազդեցությունը, եթե որպես ռեակցիայի արգասիք անլուծելի աղ է առաջանում՝
K2CO 3+ MgSO4 = MgCO3↓ + K2SO4
9. աղի լուծույթի ու մետաղի փոխազդեցությունը, եթե մետաղը ջրի հետ անմիջականորեն չի փոխազդում և մետաղների համեմատական ակտիվության շարքում աղի բաղադրությունում առկա մետաղի համեմատ ձախ է տեղադրված՝
Zn+CuSO4=ZnCl2+CuCu+2AgNO3=Cu(NO3)+2Ag
10. մետաղի ու ոչ մետաղի փոխազդեցությունը՝
Ca + S = CaSZn+Br2=ZnBr2
Աղերի քիմիական հատկությունը
Աղերը փոխազդում են՝
1. Մետաղների հետ:
Աղերի ու մետաղների փոխազդեցությունը սովորաբար հանգեցնում է աղի ու մետաղի առաջացման (տեղակալման ռեակցիա)։ Փոխազդող նյութերն ընտրվում են ըստ մետաղների համեմատական ակտիվության շարքի։ Ընդ որում` յուրաքանչյուր մետաղ դուրս է մղում իրեն հաջորդող բոլոր մետաղները դրանց աղերի լուծույթներից։
Օրինակ՝
Fe + CuSO 4= FeSO 4+ Cu
2. Հիմքերի հետ:
Այս փոխազդեցությունը հանգեցնում է նոր հիմքի և նոր աղի առաջացման (հիշեցնենք, որ ելանյութ աղը պետք է ջրում լուծելի լինի, իսկ արգասիքների թվում կա՛մ անլուծելի հիմք, կա՛մ անլուծելի աղ լինի):
Օրինակ՝
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
3. Թթուների հետ:
Այս փոխազդեցությունը հանգեցնում է նոր թթվի և նոր աղի առաջացման (ելանյութերն անհրաժեշտ է ընտրել այնպես, որ արգասիքների թվում անլուծելի, կամ թույլ, կամ անկայուն թթու, կամ էլ անլուծելի աղ լինի)։
Օրինակ՝
BaCl 2+ H2SO4 = BaSO4↓ + 2HCl
4. Աղերի հետ:
Այս փոխազդեցությունը հանգեցնում է երկու նոր աղի առաջացման։ Փոխազդող նյութերը պետք է այնպես ընտրել, որ ելանյութերը ջրում լուծելի լինեն, իսկ արգասիքներից գոնե մեկն անլուծելի լինի:
Օրինակ՝
CuSO4 + Ba(NO3 )2= 2BaSO4↓ + Cu(NO3)2
5. Ոչ մետաղների հետ:
Այսպիսի փոխազդեցությունը բնորոշ է հալոգեններին (VII Ա խմբի տարրեր), հանգեցնում է աղի ու ոչ մետաղի առաջացման (տեղակալման ռեակցիա), ընդ որում` յուրաքանչյուր հալոգեն դուրս է մղում պակաս ակտիվ հալոգենը վերջինիս աղի լուծույթից:
Օրինակ՝
2KBr + Cl2 = 2KCl + Br2
Աղեր:Դասակարգումը:Ստացման եղանակները:Աղերի քիմիական հատկությունները:
Չեզոք աղերը կազմված են մետաղի ատոմներից ու մետաղի ատոմով տեղակալվելու ընդունակ ջրածնի ատոմներ չպարունակող թթվային մնացորդից։
Տարբեր մետաղների չեզոք աղերի օրինակներ՝
| Աղի անվանումը | Աղի բանաձը |
| Նատրիումի նիտրատ | NaNO3 |
| Կալցիումի կարբոնատ | CaCO3 |
| Նիկելի (II) սուլֆատ | NiSO4 |
| Կոբալտի (II) սուլֆատ | CoSO4 |
Թթու աղերը կազմված են մետաղի ատոմներից ու մետաղի ատոմով դեռևս տեղակալվելու ընդունակ ջրածնի ատոմներ պարունակող թթվային մնացորդից։Թթու աղերը բազմահիմն թթուների ոչ լրիվ չեզոքացման արգասիքներն են։
Օրինակ՝
H2SO3+NaOH=NaHSO3+H2O
Թթու աղերն անվանակարգելիս թթվային մնացորդի անվանմանն ավելացվում է «հիդրո» նախածանցը:Որոշ թթու աղերի օրինակներ.
| Աղի անվանումը | Աղի բանաձևը |
| Նատրիումի հիդրոսուլֆատ | NaHSO4 |
| Կալիումի հիդրոֆոսֆատ | K2HPO4 |
| Ամոնիումի երկհիդրոֆոսֆատ | (NH4)H2P O4 |
| Կալցիումի հիդրոկարբոնատ | Ca(HCO3)2 |
Աղերի ստացման եղանակները հիմնված են անօրգանական միացությունների քիմիական հատկությունների վրա:
Աղերի ստացման հիմնական եղանակներն են.
1. հիմքի և թթվի փոխազդեցությունը՝
Ba(OH)2 + 2HCl = BaCl 2+ H2O
2. ալկալու և թթվային օքսիդի փոխազդեցությունը՝
2NaOH + CO2 = Na2SO 3+ H2O
3.ալկալու և լուծելի աղի փոխազդեցությունը (եթե ջրում չլուծվող հիմք է առաջանում)՝
2KOH + CuCl2 = Cu(OH)2↓ + 2KCl
4. հիմնային օքսիդի ու թթվային օքսիդի փոխազդեցությունը՝
MgO + CO2 = MgCO3
5. թթվի ու հիմնային օքսիդի փոխազդեցությունը՝
CuO + 2HCl = CuCl 2+ H2O
6. թթվի ու աղի փոխազդեցությունը, եթե անլուծելի թթու, անլուծելի աղ կամ պակաս ցնդող թթու է առաջանում՝
AgNO3 + HCl = AgCl↓ + HNO3
7.թթվի ու մետաղի փոխազդեցությունը՝
Zn + 2HCl = ZnCl2 + H2↑
8. երկու աղի լուծույթների փոխազդեցությունը, եթե որպես ռեակցիայի արգասիք անլուծելի աղ է առաջանում՝
K2CO 3+ MgSO4 = MgCO3↓ + K2SO4
9. աղի լուծույթի ու մետաղի փոխազդեցությունը, եթե մետաղը ջրի հետ անմիջականորեն չի փոխազդում և մետաղների համեմատական ակտիվության շարքում աղի բաղադրությունում առկա մետաղի համեմատ ձախ է տեղադրված՝
Zn+CuSO4=ZnCl2+CuCu+2AgNO3=Cu(NO3)+2Ag
10. մետաղի ու ոչ մետաղի փոխազդեցությունը՝
Ca + S = CaSZn+Br2=ZnBr2
Աղերի քիմիական հատկությունը
Աղերը փոխազդում են՝
1. Մետաղների հետ:
Աղերի ու մետաղների փոխազդեցությունը սովորաբար հանգեցնում է աղի ու մետաղի առաջացման (տեղակալման ռեակցիա)։ Փոխազդող նյութերն ընտրվում են ըստ մետաղների համեմատական ակտիվության շարքի։ Ընդ որում` յուրաքանչյուր մետաղ դուրս է մղում իրեն հաջորդող բոլոր մետաղները դրանց աղերի լուծույթներից։
Օրինակ՝
Fe + CuSO 4= FeSO 4+ Cu
2. Հիմքերի հետ:
Այս փոխազդեցությունը հանգեցնում է նոր հիմքի և նոր աղի առաջացման (հիշեցնենք, որ ելանյութ աղը պետք է ջրում լուծելի լինի, իսկ արգասիքների թվում կա՛մ անլուծելի հիմք, կա՛մ անլուծելի աղ լինի):
Օրինակ՝
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
3. Թթուների հետ:
Այս փոխազդեցությունը հանգեցնում է նոր թթվի և նոր աղի առաջացման (ելանյութերն անհրաժեշտ է ընտրել այնպես, որ արգասիքների թվում անլուծելի, կամ թույլ, կամ անկայուն թթու, կամ էլ անլուծելի աղ լինի)։
Օրինակ՝
BaCl 2+ H2SO4 = BaSO4↓ + 2HCl
4. Աղերի հետ:
Այս փոխազդեցությունը հանգեցնում է երկու նոր աղի առաջացման։ Փոխազդող նյութերը պետք է այնպես ընտրել, որ ելանյութերը ջրում լուծելի լինեն, իսկ արգասիքներից գոնե մեկն անլուծելի լինի:
Օրինակ՝
CuSO4 + Ba(NO3 )2= 2BaSO4↓ + Cu(NO3)2
5. Ոչ մետաղների հետ:
Այսպիսի փոխազդեցությունը բնորոշ է հալոգեններին (VII Ա խմբի տարրեր), հանգեցնում է աղի ու ոչ մետաղի առաջացման (տեղակալման ռեակցիա), ընդ որում` յուրաքանչյուր հալոգեն դուրս է մղում պակաս ակտիվ հալոգենը վերջինիս աղի լուծույթից:
Օրինակ՝
2KBr + Cl2 = 2KCl + Br2
Հիմքեր:Դասակարգումը:Ստացման եղանակները:Հիմքերի քիմիական հատկությունները:
Հիմքերի շարքին են դասվում այն նյութերը, որոնց մոլեկուլում մետաղի ատոմը կապված է մեկ կամ մի քանի հիդրօքս՝ (OH), խմբի հետ։ Քիմիական ռեակցիաների ընթացքում հիդրօքս խումբը կարող է մի նյութից անփոփոխ անցնել մեկ այլ նյութի:
Հիմքերի բաղադրություններում պարունակվող հիդրօքսո՝ (OH), խումբը միավալենտ է,ուստի հիմքերի բաղադրությունը արտահայտվում է հետևյալ ընդհանուր բանաձևով՝ Me(OH)n, որտեղ Me-ն մետաղն է, իսկ n-ը թվապես հավասար է տվյալ հիդրօքսիդում Me-ի օքսիդացման աստիճանին։
Հիմքերը հիմնականում իոնային միացություններ են. կապը մետաղի ատոմի և (OH) խմբի միջև իոնային է:
Հիմքերի թվին է դասվում նաև ամոնիումի հիդրօքսիդը՝ NH4OH (այդ նյութին համապատասխանող ջրային լուծույթը կենցաղում հայտնի է անուշադրի սպիրտ
անվանմամբ)։
Հիմքերի դասակարգումը
Հիմքերը դասակարգվում են ըստ ջրում լուծվելու ունակության` լուծելի (ալկալիներ) և անլուծելի:
Ջրում լուծելի են միայն ալկալիական և հողալկալիական մետաղների հիդրօքսիդները, դրանք թվով 8-ն են՝LiOH,NaOH,KOH,RbOH,CsOH,Ca(OH)2,Ba(OH)2Sr(OH)2:
Ալկալի է համարվում նաև NH4OH-ը:
Հիմքերի ստացումը
Ալկալիները (ջրում լուծելի հիմքերը) կարող են ստացվել.
• համապատասխան մետաղի ու ջրի փոխազդեցությունից՝
2Na + 2H2O = 2NaOH + H2↑
Ba + 2H2O = Ba(OH)2 + H2↑⏐
• համապատասխան մետաղի օքսիդի ու ջրի փոխազդեցությունից՝
Li2O + H2O = 2LiOH
BaO + H2O = Ba(OH)2
Ջրում չլուծվող հիմքերն ստացվում են համապատասխան մետաղի լուծելի աղի ու ալկալու փոխազդեցությունից, օրինակ՝
CrSO4 + 2NaOH = Cr(OH)2↓ + Na2SO4
Cu(NO3)2+2KOH = Cu(OH)2↓ + 2KNO3
MnCl 2+ Ba(OH)2 = Mn(OH)2↓ + BaCl2
Հիմքերի քիմիական հատկությունները
1.Հիմքերի փոխազդեցությունը հայտանյութերի հետ
Ջրում լուծելի հիմքերը` ալկալիները, գունավորում են հայտանյութերը` լակմուսը` կապույտ, մեթիլօրանժը` դեղին, իսկ ֆենոլֆտալեինը՝ մորեգույն։
2.Հիմքերի և թթուների փոխազդեցությունը
Թթուների հետ փոխազդում են և լուծվող, և անլուծելի հիմքերը՝ առաջացնելով աղ և ջուր (չեզոքացման ռեակցիա):
2NaOH + H2SO 4= Na2SO 4 + 2H2O
Cu(OH)2 + H2SO 4 = CuSO 4 + 2H2O
2KOH + H2S = K2S + 2H2O
3.Ալկալիների և թթվային օքսիդների փոխազդեցությունը
Ba(OH)2 + CO2 = BaCO3↓ + H2O
Ca(OH)2 + SO2 = CaSO3↓ + H2O
4.Ալկալիների և աղերի փոխազդեցությունը
Այս փոխազդեցությունը հանգեցնում է նոր հիմքի և նոր աղի առաջացման։ Ըստ որում` ելանյութ աղը պետք է ջրում լուծելի լինի, իսկ արգասիքների թվում կամ անլուծելի հիմք,
կամ անլուծելի աղ լինի՝
FeSO 4+ 2KOH = Fe(OH)2↓ + K2SO
4Na2SO 4+ Ba(OH)2 = BaSO 4↓ + 2NaOH
5.Ալկալիների և ոչ մետաղների փոխազդեցությունը
Ոչ մետաղներից ալկալիները փոխազդում են, հիմնականում հալոգենների հետ։ Այս դեպքում, որպես կանոն` կրկին աղ և ջուր են առաջանում, օրինակ՝
Cl2+ 2NaOH = NaCl + NaCl + H2O
6. Անլուծելի հիմքերի քայքայումը
Անլուծելի հիմքերը հիմնականում անկայուն են ու տաքացնելիս քայքայվում են` ջուր և հիմնային օքսիդ առաջացնելով, օրինակ՝
Cu(OH)2 = CuO + H2O
2Al(OH)3 = Al2O3 + 3H2O
Ալկալիները կայուն նյութեր են, ուստի չափավոր տաքացնելիս չեն քայքայվում։
Երկդիմի հիդրօքսիդներ
Նյութերը, որոնք ցուցաբերում են և՛ թթվային, և՛ հիմնային հատկություններ, անվանվում են երկդիմի (ամֆոտեր)։
Երկդիմությունը (ամֆոտերությունը) նյութի հատկությունն է` փոխազդելու և՛ թթուների, և՛ հիմքերի հետ։
1.Երկդիմի հիդրօքսիդների և թթուների փոխազդեցությունը՝
Zn(OH)2+2HCl=ZnCl2+2H2O
Al(OH)3+3HCl=AlCl3+3H2O
2. Երկդիմի հիդրօքսիդների և ալկալիների փոխազդեցությունը՝
Zn(OH)+22NaOH=Na2ZnO2+2H2O
Al(OH)3+NaO3H=NaAlO2+2H2O
Օքսիդների քիմիական հատկությունները
Հիմնային օքսիդների քիմիական հատկությունները
1. Ալկալիական և հողալկալիական մետաղների օքսիդները փոխազդում են ջրի հետ՝ առաջացնելով ջրում լուծվող հիմքեր՝ ալկալիներ:
Հիմնային օքսիդ + ջուր →հիդրօքսիդ
Օրինակ
Կալցիումի օքսիդի և ջրի փոխազդեցությունից առաջանում է կալցիումի հիդրօքսիդ:
CaO+H2O→Ca(OH)2
2. Հիմնային օքսիդները փոխազդում են թթուների հետ՝ առաջացնելով աղ և ջուր
Հիմնային օքսիդ + թթու → աղ + ջուր
CuO+H2SO4→CuSO4+H2O
3. Հիմնային օքսիդները կարող են փոխազդել այլ տեսակի (թթվային և երկդիմի) օքսիդների հետ՝ առաջացնելով աղեր:
Հիմնային օքսիդ + թթվային օքսիդ →աղ
Հիմնային օքսիդ + թթվային օքսիդ →աղ
Օրինակ
Մագնեզիումի օքսիդը փոխազդելով ածխածնի (IV) օքսիդի հետ՝ առաջացնում է մագնեզիումի կարբոնատ:
MgO+CO2→MgCO3
Թթվային օքսիդների քիմիական հատկությունները
1. Թթվային օքսիդները փոխազդում են ջրի հետ` առաջացնելով թթու:
Թթվային օքսիդ + ջուր → թթու
Օրինակ
Ծծմբի (VI) օքսիդը փոխազդում է ջրի հետ՝ առաջացնելով ծծմբական թթու:
SO3+H2O→H2SO4
2. Թթվային օքսիդները փոխազդում են ալկալիների հետ՝ առաջացնելով աղ և ջուր:
Թթվային օքսիդ + հիմք → աղ + ջուր
Օրինակ
Ծծմբի (IV) օքսիդը, փոխազդելով նատրիումի հիդրօքսիդի հետ,՝առաջացնում է նատրիումի սուլֆատ և ջուր:
SO2+2NaOH→Na2SO3+H2O
3. Թթվային օքսիդները փոխազդում են հիմնային օքսիդների հետ՝ առաջացնելով աղեր:
Թթվային օքսիդ +հիմնային օքսիդ →աղ
Օրինակ
Ածխածնի (IV) օքսիդը փոխազդելով կալցիումի օքսիդի հետ՝ առաջացնում է կալցիումի կարբոնատ:
CO2+CaO→CaCO3
Երկդիմի (ամֆոտեր) օքսիդների քիմիական հատկությունները
1.Երկդիմի օքսիդները փոխազդելով թթուների կամ թթվային օքսիդների հետ ցուցաբերում են հիմնային օքսիդներին բնորոշ (հիմնային) հատկություններ:
Օրինակ
Ցինկի օքսիդի և աղղաթթվի փոխազդեցությունից առաջանում է ցինկի քլորիդ և ջուր:
ZnO+2HCl→ZnCl2+H2O
Իսկ ալյումինի օքսիդի և ազոտի (V) օքսիդի փոխազդեցությունից առաջանում է ալյումինի նիտրատ՝
Al2O3+3N2O5=2Al(NO3)3
2. Երկդիմի օքսիդները՝ փոխազդելով ալկալիների կամ ալկալիական և հողալկալիական մետաղների օքսիդների հետ, ցուցաբերում են թթվային հատկություններ:
Երկդիմի օքսիդների և ալկալիների համահալումից ընթանում է քիմիական ռեակցիա, որի հետևանքով առաջանում է աղ և ջուր:
Օրինակ
Ցինկի օքսիդի և կալիումի հիդրօքսիդի համահալումից առաջանում է կալիումի ցինկատ և ջուր:
ZnO+2KOH→K2ZnO2+H2O
Եթե ալյումինի օքսիդը համահալել նատրիումի հիդրօքսիդի հետ, ապա կառաջանա նատրիումի ալյումինատ և ջուր՝
Al2O3+2NaOH→2NaAlO2+H2O
Բերիլիումի օքսիդի և կալիումի օքսիդի փոխազդեցությունից առաջանում է նատրիումի բերիլատ՝
BeO+Na2O=Na2BeO2
Թթուներ:Դասակարգումը:Ստացման եղանակները:ԹԹունների քիմիական հատկությունները:
Թթուները բարդ նյութեր են, որոնց մոլեկուլները կազմված են մեկ կամ մի քանի ջրածնի ատոմներից և թթվային մնացորդից:
Բոլոր թթուների ջրային լուծույթները թթու համ ունեն և դրանք օժտված են նույնանման հատկություններով՝ իրենց բաղադրիչ տարրի՝ ջրածնի շնորհիվ:
Ոչ բոլոր թթուների լուծույթները կարելի է համտեսել. դրանց մեջ հանդիպում են հյուսվածքներ քայքայողներ, նույնիսկ թունավորներ:
Մրջունները «թշնամիներից» պաշտպանվելու նպատակով արտաթորում են մրջնաթթվի կծու կաթիլներ:

Այս նույն թթուն արկա է եղինջի տերևների «խայթող» մազիկներում:

Ցանկացած թթվի մոլեկուլի բաղադրությունը, անկախ ծագումից (օրգանական, կամ հանքային), արտահայտվում է հետևյալ ընդհանուր բանաձևով՝ HnR , որտեղ R-ը թթվային մնացորդն է, n-ը՝ ջրածնի ատոմների թիվը:
Թթվային մնացորդներն ունեն որոշակի բաղադրություն և վալենտականություն, վերջինս որոշվում է ըստ մետաղներով տեղակալվելու ընդունակ ջրածնի ատոմների թվի:Որոշ հանքային թթուների և թթվային մնացորդների անվանումները
Թթուները մեծ տարածվածություն ունեն բնության մեջ: Օրինակ՝ կիտրոնում պարունակվում է կիտրոնաթթու, խնձորի մեջ՝ խնձորաթթու, թրթնջուկի տերևներում՝ թրթնջկաթթու:
Թթուների ստացման եղանակները
Անթթվածին թթուները ստացվում են համապատասխան գազային ջրածնային միացությունները ջրում լուծելով, իսկ գազային ջրածնային միացությունները ստացվում են
ա) ջրածնի և համապատասխան ոչ մետաղի անմիջական փոխազդեցությունից.
H2+F2=2HF
H2+Br2=2HBr
H2+S=H2S
H2+Cl2=2HCl
բ) համապատասխան աղի և մեկ այլ` ավելի ուժեղ թթվի փոխազդեցությունից.
FeS+H2SO4=FeSO4+H2S↑
NaCl(պինդ) +H2SO4(խիտ) =NaHSO4+HCl↑ (լաբորատորեղանակ)
2NaCl(պինդ) +H2SO4(խիտ) =Na2SO4+2HCl↑ (արդյունաբերականեղանակ)
գ) որոշ այլ փոխազդեցություններից։
Օրինակ՝ ավելի ակտիվ ոչ մետաղները դուրս են մղում պակաս ակտիվները
համապատասխան թթուներից.
2HJ + Br2 = 2HBr + J2
H2S + Cl2 = 2HCl + SH2
S + Cl2 = 2HCl + S
Թթվածնային թթուների ստացման հիմնական եղանակ (համապատասխան օքսիդի ու ջրի փոխազդեցությունն արդեն նշվել է «Ջրածին» և «Օքսիդներ» թեմաներում):
Թթվածնային թթու է ստացվում նաև այդ թթվի աղի և այլ թթվի փոխազդեցությունից,
եթե.
ա) ստացվող թթուն, փոխազդող թթվի համեմատ` ցնդող է.
NaNO3 + H2SO4 = NaHSO4 + HNO3
բ) որպես ռեակցիայի արգասիք՝ ջրում անլուծելի աղ կամ թթու է առաջանում.
Na2SiO 3+ 2HNO3 = H2SiO3↓ + 2NaNO3
Թթուների քիմիական հատկությունները
Թթուների որոշ քիմիական հատկություններին (փոխազդեցությունը մետաղների ու մետաղների օքսիդների հետ) հանգամանորեն անդրադարձել ենք «Ջրածին» և «Թթվածին» թեմաներում։ Ուստի այստեղ կներկայացնենք թթուներին բնորոշ այլ հատկությունները:
1.Թթուների փոխազդեցությունը հայտանյութերի հետ.Բոլոր թթուների ջրային լուծույթները գունավորում են հայտանյութեր՝
լակմուսը` կարմիր, մեթիլօրանժը` մուգ վարդագույն, իսկ ֆենոլֆտալեինը թթուներում չի գունավորվում:
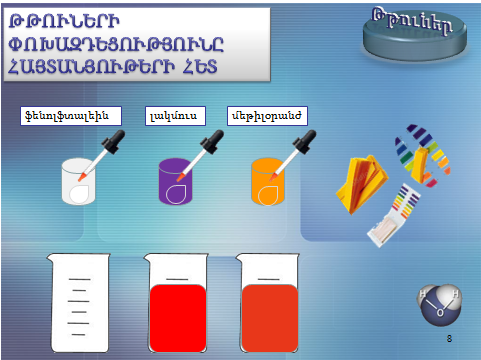
2.Թթուների և հիմքերի փոխազդեցությունը
Թթուներին առավել բնորոշ է հիմքերի (ինչպես ալկալիների, այնպես էլ` ջրում չլուծվող) հետ փոխազդեցությունը` չեզոքացման ռեակցիան, որի հետևանքով առաջանում է աղ և ջուր.
LiOH + HCl = LiCl + H2O
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
3.Թթուների և աղերի փոխազդեցությունը
Նման ռեակցիա իրականացնելու համար անհրաժեշտ է ելանյութերն ընտրել այնպես, որ արգասիքների թվում լինի.
ա) անլուծելի թթու.
H2SO 4+ Na2SiO3= Na2SO4 + H2SiO3↓
բ) թույլ թթու.
CH3COOK + HBr = CH3COOH + KBr
գ) անկայուն թթու.
K2CO3 + 2HBr = 2KBr + CO2↑ + H2O
դ) անլուծելի աղ.
AgNO3 + HBr = AgBr↓ + HNO3
4. Որոշ թթուներ տաքացնելիս քայքայվում են.
H2SiO3= SiO2 +H2O
H2SO3= SO2 +H2O
Չեզոքացման ռեակցիա, չեզոքացում, թթվի հատկություններ ունեցող նյութերի և հիմքի հատկություններ ունեցող նյութերի միջև ընթացող քիմիական ռեակցիա, որի հետևանքով այդ նյութերը կորցնում են թթուներին ու հիմքերին բնորոշ հատկությունները։
Պատասխանել հարցերին
Որոշե՛ք թթու առաջացնող տարրերի օքսիդացման աստիճանը հետևյալ թթուններում.
HNO3-, H2SiO3 ,HNO3 , HCIO4 , H3PO4
1․H+1NO2-1
2․H+12SiO3-2
3․H+1NO3-1
4․H+1ClO4+1
Ո՞ր ռեակցիաներն են անվանվում չեզոքացման :
Թթուներին առավել բնորոշ է հիմքերի (ինչպես ալկալիների, այնպես էլ` ջրում չլուծվող) հետ փոխազդեցությունը` չեզոքացման ռեակցիան, որի հետևանքով առաջանում է աղ և ջուր։
Գրե՛ք հետևյալ փոխարկումներին համապատասխանող քիմիական ռեակցիաների հավասարումները.
S- SO2-SO3-H2SO4— BaSO4
Օքսիդացման աստիճան
Քիմիայում առավել հաճախ օգտագործվում է օքսիդացման աստիճան հասկացությունը: Որպեսզի հասկանանք այդ հասկացության իմաստը, համեմատենք լիցքերի առաջացումը նատրիումի քլորիդում` NaCI:Նատրիումի քլորիդն առաջանալիս տեղի է ունենում էլեկտրոնի անցում նատրիումի ատոմից քլորի ատոմին, և առաջանում են լիցքավորված մասնիկներ` Na+ևCl− , որոնք էլեկտրաստատիկ ձգողության ուժերով ձգում են միմյանց՝ առաջացնելով իոնային բյուրեղավանդակ:Բյուրեղավանդակում Na+ևCl− իոնների թվի հարաբերությունը կազմում է 1:1, որի պատճառով նատրիումի քլորիդ նյութի համար ընդունված է NaCI բանաձևը, չնայած պինդ վիճակում այդպիսի մոլեկուլ գոյություն չունի:Բոլոր իոնային միացությունները գրառում են այնպիսի քիմիական բանաձևերով, ինչպիսիք ընդունված են մոլեկուլային միացությունների համար:Իոնային միացություններում տարրի վալենտականությունը հավասար է իոնի լիցքին:Մոլեկուլն առաջանալիս տեղի է ունենում ընդհանուր էլեկտրոնային զույգի շեղում դեպի էլեկտրաբացասական տարրի ատոմը, որի հետևանքով ատոմները ձեռք են բերում մասնակի դրական, կամ մասնակի բացասական լիցք:Քիմիական միացություններում ատոմների նման վիճակը բնութագրելու համար ընդունված է այդ լիցքերը հաշվել ոչ թե մասնակի, այլ ամբողջական:Որպեսզի պայմանական լիցքը չշփոթեն իոնի լիցքի հետ, այն անվանել են օքսիդացման աստիճան:Տարրի օքսիդացման աստիճանը պայմանական այն լիցքն է, որը քիմիական միացության մոլեկուլում վերագրվում է ատոմին` ենթադրելով, թե միացությունը կազմված է միայն իոններից:Օքսիդացման աստիճանը նշանակվում է արաբական թվանշանով, դրվում է քիմիական նշանի վերևում, ընդ որում սկզբից գրվում է նշանը (+ կամ –), ապա՝ լիցքի թվային արժեքը:ՕրինակՔլորաջրածնի մոլեկուլում ջրածին տարրի օքսիդացման աստիճանը +1 է, իսկ քլորինը` –1, որն էլ գրառվում է այսպես՝ H+1Cl−1:Օքսիդացման աստիճանի մեծությունը որոշվում է միացության մոլեկուլում դեպի տվյալ ատոմը կամ տվյալ ատոմից շեղված էլեկտրոնների թվով:Օքսիդացման աստիճանը կարող է ունենալ դրական, բացասական և զրոյական արժեքներ:Երբեմն օքսիդացման աստիճանը թվապես համընկնում է տվյալ միացության մոլեկուլում տարրի ատոմի վալենտականությանը:ՕրինակԱծխածնի (IV) օքսիդի մոլեկուլում CO2 բաղադրիչ քիմիական տարրերի` ածխածնի(C) և թթվածնի(O) ատոմների և’ վալենտականությունները, և’ օքսիդացման աստիճանները (բացարձակ արժեքով) համապատասխանաբար հավասար են՝ 4 և 2:Սակայն միշտ չէ, որ նշված մեծությունները համընկնում են: Պարզ նյութերի, օրգանական միացությունների մոլեկուլներում հիմնականում չեն համընկնում: Ազոտի N2 մոլեկուլում ազոտի ատոմի վալենտականությունը 3 է (N≡N), մինչդեռ օքսիդացման աստիճանը՝ զրո:Միացությունում ավելի մեծ էլեկտրաբացասականությամբ քիմիական տարրի ատոմի օքսիդացման աստիճանը բացասական է, իսկ կապեր առաջացնող մյուս տարրերի ատոմներինը՝ դրական: Օքսիդացման աստիճանը, ինչպես և վալենտականությունը կարող են լինել հաստատուն և փոփոխական:Փոփոխական օքսիդացման աստիճանները միացություններում որոշվում են ըստ բանաձևի:Տարրերի օքսիդացման աստիճանները որոշելիս անհրաժեշտ է պահպանել հետևյալ սկզբունքները.1. Պարզ նյութերի մոլեկուլներում տարրերի ատոմների օքսիդացման աստիճանները միշտ հավասար են 0-ի: ՕրինակH02,O02,Cl02,Zn02.Ոչ մետաղների հետ առաջացրած միացություններում ջրածնի օքսիդացման աստիճանը հիմնականում +1 է, ակտիվ մետաղների հետ առաջացրած միացություններում` հիդրիդներում −1 է:3. Թթվածինը միացություններում հիմնականում դրսևորում է –2-ի հավասար օքսիդացման աստիճան, պերօքսիդներում` –1:ՕրինակH2O2 -ում թթվածնի օքսիդացման աստիճանը –1 է:4. I,II,III խմբերի մետաղների օքսիդացման աստիճանները հավասար են խմբերի համարներին, բացառությամբ I խմբի երկրորդական ենթախմբի:5. Միացություններում բոլոր ատոմների գումարային լիցքը հավասար է զրոյի: Պատասխանել հարցերին 1.Ի՞նչ եք հասկանում տարրի օքսիդացման աստիճան ասելով: Որպեսզի հասկանանք այդ հասկացության իմաստը, համեմատենք լիցքերի առաջացումը նատրիումի քլորիդում` NaCI: 2.Ինչպե՞ս է գրառվում օքսիդացման աստիճանը: Բոլոր իոնային միացությունները գրառում են այնպիսի քիմիական բանաձևերով, ինչպիսիք ընդունված են մոլեկուլային միացությունների համար:Իոնային միացություններում տարրի վալենտականությունը հավասար է իոնի լիցքին:Օքսիդացման աստիճան
Քիմիայի մարտ և փետրվար ամսվա, բլոգային աշխատանքի ամփոփում՝
Մարտի 13-17՝ Բյուրեղավանդակներ
Դասի թեման ` Բյուրեղավանդակներ
Սովորական պայմաններում նյութերը կարող են լինել գազային,հեղուկ, պինդ ագրեգատային վիճակներում: Ցածր ջերմաստիճան և բարձր ճնշում կիրառելով հնարավոր է բոլոր նյութերը վերածել պինդ վիճակի: Ըստ կառուցվածքային մասնիկների դասավորվածության տարբերում են բյուրեղային և ամորֆ նյութեր: Ամորֆ վիճակում նյութը հալման հաստատուն ջերմաստիճան չունի, տաքացնելիս այն աստիճանաբար փափկում է և, ի վերջո, հոսուն վիճակի անցնում: Պատճառն այն է, որ ամորֆ նյութը կազմող մասնիկները տարածական կանոնավոր դասավորություն չունեն, և այդ առումով նման նյութերն օժտված են և՛ պինդ, և՛ հեղուկ նյութերի հատկություններով: Ամորֆ նյութերից են, օրինակ ՝ պլաստիլինը, տարբեր խեժեր,ապակին, մոմը և այլն:Պինդ բյուրեղային նյութերին հատուկ է մասնիկների (ատոմների, իոնների, մոլեկուլների) կանոնավոր, ճշգրիտ, տարածության մեջ կրկնվող դասավորությունը: Բյուրեղներում մասնիկները միմյանց միջև գործող ուժերի շնորհիվ դասավորվում են կանոնավոր տարածական բյուրեղավանդակում:Այն կետերը, որոնցում դասավորված են բյուրեղավանդակը կազմող մասնիկները, անվանվում են բյուրեղավանդակի հանգույցներ, իսկ բյուրեղավանդակում անընդհատ կրկնվող փոքրագույն բջիջները՝ տարրական բջիջներ:Բյուրեղավանդակների հանգույցներում դասավորված մասնիկների տեսակից ու դրանց միջև քիմիական կապի բնույթից ելնելով՝ տարբերում են իոնային, ատոմային, մոլեկուլային և մետաղական բյուրեղավանդակներ:
Իոնային բյուրեղավանդակի հանգույցներում էլեկտրաբացասականությամբ միմյանցից կտրուկ տարբերվող մետաղի և ոչ մետաղի իոններ են կապված իոնային կապով (NaCI,KF,RbBr,CsJ և այլն):

Նատրիումի և կալցիումի քլորիդների բյուրեղավանդակները
Ատոմային բյուրեղավանդակներիհանգույցներում առանձին ատոմներ են, որոնք միմյանց կապված են շատ ամուր կովալենտային կապերով: Նման բյուրեղավանդակով նյութի օրինակներ են ՝գրաֆիտը և ալմաստը (ածխածնի (C) տարաձևությունները):Մոլեկուլային բյուրեղավանդակների հանգույցներում մոլեկուլներ են, որոնց միջև գործող ուժերը (միջմոլեկուլային ուժեր) համեմատաբար թույլ են, իսկ մոլեկուլի ներսում գործում են կովալենտային ամուր կապեր:
Այդ պատճառով նման բյուրեղավանդակով նյութերը կարծր չեն, ցնդող են (դրա հետ կապված` հաճախ հոտ ունեն), դրանց հալման ջերմաստիճանները սովորաբար ցածր են: Այդպիսի բյուրեղավանդակով նյութի օրինակ է յոդը, պինդ վիճակում ածխածնի (IV) օքսիդը՝ «չոր սառույցը»:

Մետաղների ատոմներից կազմված նյութերում քիմիական կապը մետաղական է, և համապատասխանաբար, առաջանում են մետաղական բյուրեղավանդակներ, ինչով էլ պայմանավորված են մետաղների հատկությունները` բնորոշ մետաղական փայլը, կռելիությունը, բարձր ջերմահաղորդականությունն ու էլեկտրահաղորդականությունը և այլն։

Պատասխանել հարցերին
1.Որո՞նք են բյուրեղավանդակների տեսակները։
Բյուրեղավանդակների հանգույցներում դասավորված մասնիկների տեսակից ու դրանց միջև քիմիական կապի բնույթից ելնելով՝ տարբերում են իոնային, ատոմային, մոլեկուլային և մետաղական բյուրեղավանդակներ:
2. Պարզաբանե’ք բյուրեղավանդակ ,հանգույց,տարրական բջիջ հասկացությունները։
Բյուրեղավանդակ-Պինդ բյուրեղային նյութերին հատուկ է մասնիկների (ատոմների, իոնների, մոլեկուլների) կանոնավոր, ճշգրիտ, տարածության մեջ կրկնվող դասավորությունը: Բյուրեղներում մասնիկները միմյանց միջև գործող ուժերի շնորհիվ դասավորվում են կանոնավոր տարածական բյուրեղավանդակում:
Հանգույց և տարրական բջիջ-Այն կետերը, որոնցում դասավորված են բյուրեղավանդակը կազմող մասնիկները, անվանվում են բյուրեղավանդակի հանգույցներ, իսկ բյուրեղավանդակում անընդհատ կրկնվող փոքրագույն բջիջները՝ տարրական բջիջներ:
Մարտի 6-10
Դասի թեման՝ Վալենտականություն:Տարրերի վալենտականության որոշումն ըստ քիմիական բանաձևի Վալենտականությունը քիմիական տարրի ատոմի՝ մի այլ տարրի խիստ որոշակի թվով ատոմներ միացնելու հատկությունն է:Վալենտականությունն արտահայտվում է ամբողջ թվերով և գրվում է տարրի քիմիական նշանի վերևում` հռոմեական թվանշանով:ՕրինակՄեթանի մոլեկուլում տարրերի վալենտականությունը նշվում է հետևյալ կերպ. CH4IIVՔիմիական տարրերի վալենտականություն հասկացությունը պատկանում է (1852 թ.) անգլիացի նշանավոր քիմիկոս էդվարդ Ֆրանկլենդին:Էդվարդ Ֆրանկլենդ (1871-1937)Ըստ նրա՝ քիմիական միացության մոլեկուլում տարրի վալենտականությունը հավասար է այդ տարրի առաջացրած կապերի թվին: Նյութ առաջանալիս ատոմները կապվում են մեկը մյուսին արտաքին շերտի էլեկտրոնների փոխազդեցության հաշվին, և տարրի վալենտականությունը պայմանավորված է արտաքին էլեկտրոնների թվով, իսկ գլխավոր ենթախմբերի տարրերի արտաքին էլեկտրոնների թիվը հավասար է խմբի համարին:Քիմիական կապի առաջացմանը մասնակցող էլեկտրոններն անվանվում են վալենտային էլեկտրոններ:Ցանկացած տարրի առավելագույն վալենտականությունը հավասար է պարբերական համակարգում այդ տարրի խմբի համարին (բացառությամբ թթվածնի, ֆտորի և ազոտի):Օրինակ՝ Քտորը և մանգանը գտնվում են VII խմբում և ցուցաբերում են VI -ի հավասար առավելագույն վալենտականություն.Cl,VII MnVIIՈչ մետաղները կարող են նաև դրսևորել վալենտականություն, որի թվային արժեքը ութի և խմբի համարի տարբերությունն է:ՕրինակՔլորն ունի նաև մեկի հավասար վալենտականություն (8−7=1), թթվածինը՝ երկուսի (8−6=2), ֆտորը՝ երեքի (8−5=3):Վալենտականությունը կարող է լինել հաստատուն և փոփոխական: Այսպես, թթվածինը միշտ երկվալենտ է, ջրածինը և ֆտորը՝ միշտ միավալենտ, առաջին խմբի գլխավոր ենթախմբի տարրերը միայն միավալենտ են, երկրորդ խմբի գլխավոր ենթախմբինը՝ երկվալենտ: Ծծումբը ցուցաբերում է փոփոխական վալենտականություն՝ երկու, չորս, վեց,երկաթը՝ երկու, երեք, վեց և այլն:Փոփոխական վալենտականությամբ տարրերի առաջացրած նյութերի անուններում տարրի անվանումից հետո փակագծերում հռոմեական թվանշանով գրվում է այդ տարրի վալենտականությունը:ՕրինակSO2-ի համար գրվում է ծծմբի (IV) օքսիդ և կարդացվում է «ծծմբի չորս օքսիդ», SO3 -ի համար գրվում է ծծմբի(VI) օքսիդ և կարդացվում է «ծծմբի վեց օքսիդ»:Ժամանակակից տեսության համաձայն՝ ատոմի վալենտականությունը որոշվում է ատոմային օրբիտալներում չզույգված էլեկտրոնների թվով, որոնք ընդունակ են մասնակցելու այլ ատոմների հետ քիմիական կապի առաջացմանը: Ուստի հասկանալի է, որ վալենտականությունը միշտ արտահայտվում է ամբողջ թվերով:Վալենտականություն հասկացությունն իմաստ ունի վերագրել միայն կովալենտային կապով առաջացած միացություններին: Իոնային կապով առաջացած միացությունների համար գործածվում է իոնի լիցք հասկացությունը:Քիմիական տարրի ատոմի վալենտականությունը տարրի ատոմի առաջացրած կովալենտային կապերի թիվն է տվյալ միացության մոլեկուլում:Կովալենտային կապերի քանակը, որն առաջացնում է քիմիական տարրի ատոմը տվյալ միացությունում, հավասար է ընդհանուր էլեկտրոնային զույգերի թվին:ՕրինակԱզոտի մոլեկուլում` N2(N≡N) ազոտի ատոմի (N) վալենտականությունը 3 է, իսկ թթվածնի մոլեկուլում՝ Օ2(O=O) թթվածնի ատոմի (O)՝2:Իսկ ինչպե՞ս են որոշվում քիմիական տարրի վալենտականության հնարավոր արժեքները: Ընդունված է վալենտականության որոշման հետևյալ հասարակ կանոնը: Երկտարր միացության քիմիական բանաձևում տվյալ տարրի բոլոր ատոմների վալենտային միավորների ընդհանուր թիվը հավասար է մյուս տարրի բոլոր ատոմների վալենտային միավորների ընդհանուր թվին:Այս կանոնի հիման վրա, եթե հայտնի է մեկ տարրի վալենտականությունը, կարելի է որոշել մյուսինը՝ ըստ քիմիական բանաձևի: Տարրի ատոմի վալենտականության որոշման համար ընդունելի է գործողությունների հետևյալ հաջորդականությունը:1. Գրում ենք միացության բանաձևը և ատոմի վրա տեղադրում այն տարրի վալենտականությունը, որը հայտնի է (մեր օրինակում՝ թթվածնի և ջրածնի վալենտականությունները).2. Գտնում ենք այդ տարրերի վալենտային միավորների ընդհանուր թիվը՝ տարրերի վալենտականության թվային արժեքը բազմապատկելով ինդեքսով.3. Գտնում ենք մյուս տարրի վալենտականությունը՝ վալենտային միավորների ընդհանուր թիվը բաժանելով այդ տարրի ինդեքսին, և տեղադրում քիմիական նշանի վերևում.Պատասխանել հարցերին Վալենտականությունը քիմիական տարրի ատոմի՝ մի այլ տարրի խիստ որոշակի թվով ատոմներ միացնելու հատկությունն է:Մարտի 6-10
Co2=Co4
Sio2=Sio4
N2O3=N3 O-2
N2O3=N5 O2
CI 2O=CI4O
